Publicado em: ImplantNews;8(5):627-636, 2011.
Autores:
Deceles Cristina Costa Alves – Especialista em Prótese – CEO-Ipsemg; Mestre em Implantodontia – São Leopoldo Mandic de Campinas.
Ernani Tadeu de Souza – Especialista em Prótese – UFMG; Mestre em Implantodontia – São Leopoldo Mandic de Campinas.
Paulo Sérgio Perri de Carvalho – Professor titular do Departamento de Cirurgia e Clínica Integrada – Faculdade de Odontologia de Araçatuba-Unesp; Coordenador do Programa de Mestrado Profi ssionalizante em Implantodontia – São Leopoldo Mandic de Campinas.
Vinícius de Carvalho Machado – Especialista em Radiologia e Estomatologia – São Leopoldo Mandic de Campinas.
RESUMO
A obtenção do reparo ósseo pode ser prejudicada pela invasão de células fibroblásticas na loja cirúrgica, o que resulta em tecido conjuntivo cicatricial. A utilização de biomateriais como barreiras evita, ou até mesmo impede, a invasão de fibroblastos, permitindo maior intervalo de tempo para que as células osteoprogenitoras se alojem na área do defeito e promovam a neoformação óssea. No entanto, o problema está em criar e manter um espaço suficiente, entre a membrana e o defeito ósseo, para que ocorra a regeneração. Este trabalho teve como objetivo apresentar e discutir o resultado clínico da utilização de um fio de sutura de reabsorção lenta, o PDS II, como um arcabouço, de maneira a criar e manter o espaço necessário. Por ter a capacidade de resistir à tensão por várias semanas, se manteve convexo no local desejado, sustentando o tecido gengival, tempo suficiente para permitir colonização, organização e proteção do tecido neoformado. Unitermos – Implantes dentários; Regeneração óssea guiada; Técnica PDS II.
Introdução
A reabilitação de pacientes com defeitos ósseos extensos ou quantidade óssea insuficiente tem sido um dos maiores desafios da Implantodontia. Após a perda de elementos dentais, o osso alveolar edêntulo geralmente é afetado por um processo de reabsorção irreversível. Normalmente, ocorre perda em largura e altura do rebordo ósseo, bem como diminuição do trabeculado e densidade, causada pela falta de estímulo ao osso residual (1).
Várias técnicas, visando o aumento do volume ósseo, podem ser realizadas antes ou concomitantemente à instalação de implantes. Os procedimentos de regeneração tecidual guiada (RTG), preconizada na Periodontia (2-3), possibilitaram o desenvolvimento da técnica de regeneração óssea guiada (ROG), que tem sido uma alternativa para contornar as dificuldades nos processos de reparo do tecido ósseo em defeitos críticos (4-6).
Na regeneração óssea, o principal obstáculo é a formação mais rápida do tecido conjuntivo, quando comparada à osteogênese. Com o objetivo de prevenir que o tecido conjuntivo interfira no direcionamento da formação óssea, a ROG baseia-se no conceito da osteopromoção, que usa meios físicos, barreiras ou membranas, para promover um selamento total de um local anatômico. A barreira é colocada em contato direto com a superfície óssea circundante, posicionando o periósteo na superfície externa da membrana (7) . Isto permite obter uma dimensão isolada na qual as células osteogênicas possam sofrer amplificação de sua divisão celular dentro de um meio estável (8). O novo osso será formado onde existe estabilidade biomecânica da membrana (9).
Alguns estudos citaram a importância da conservação de um revestimento biológico adequado, com um retalho espesso e sem tensão, que garanta uma fonte adequada de vascularização para que o sucesso da técnica seja assegurado (10). Pode-se dizer que a formação óssea depende de dois requisitos indispensáveis: um amplo suporte sanguíneo e suporte mecânico, proporcionado pelas membranas (11).
Observando as propriedades ideais necessárias para as membranas (12), foram desenvolvidas as membranas não reabsorvíveis e as reabsorvíveis. As membranas não reabsorvíveis devem manter a integridade estrutural e suas características durante o tempo em que permanecerem no local desejado, sendo necessária a remoção em uma segunda intervenção cirúrgica (13). Em função de sua rigidez e propriedades hidrofóbicas, precisam ser mantidas em posição por parafusos e pinos. Normalmente, são de difícil manuseio, propensas à exposição precoce e deiscências de tecido mole (12).
Já as membranas constituídas por materiais reabsorvíveis não precisam ser removidas, pois devem ser degradadas e absorvidas in vivo (14).
No entanto, a propriedade das membranas serem reabsorvíveis ou não, é considerada menos importante que a sua capacidade de criar um espaço, suficientemente grande, a fi m de que células indiferenciadas possam proliferar-se a partir das áreas laterais ao defeito e formar novo osso (15).
Em locais com defeitos ósseos largos, não há suporte suficiente capaz de prevenir o colapso da membrana contra o interior do defeito, o qual ocluiria o espaço. Nestes casos, é necessário usar material de enxerto ósseo para dar suporte à membrana, parafusos ou membranas com reforço de titânio (16).
Também foi observado que o coágulo formado, embaixo da membrana, pode sofrer certa contração durante os estágios iniciais da cicatrização, diminuindo a quantidade de regeneração óssea. O uso de algum material de enxerto capaz de estabilizar o coágulo ajudaria a melhorar a formação óssea (17).
Os materiais para preenchimento ósseo devem ser capazes de sustentar a membrana, acelerar a neoformação óssea, agir como arcabouço para a invaginação óssea proveniente do leito receptor e ajudar na manutenção do volume ósseo ao longo do tempo (18). Lascas de osso autógeno, que possuem propriedades osteogênicas, podem acelerar a neoformação óssea em defeitos protegidos por membranas, mas não são capazes de manter o volume conseguido. Já os substitutos ósseos, que apresentam baixa taxa de substituição, são capazes de manter o volume ósseo criado, mas não possuem propriedades osteogênicas. Uma combinação de ambos seria recomendada, a fim de preencher os requisitos citados (18-19).
Na pré-maxila, a perda dos dentes anteriores geralmente compromete o volume ósseo, ficando a posição ideal para colocação de implantes comprometida (20). Sempre que houver condições favoráveis, a escolha da técnica de ROG simultaneamente à instalação de implantes deve ser preferida, a fim de limitar o número de intervenções cirúrgicas (11). No entanto, é de fundamental importância a colocação do implante em uma posição tridimensional, do ponto de vista estético e funcional, atingindo a estabilidade primária suficiente nesta posição específica. O defeito ósseo peri-implantar deve ter uma morfologia favorável, com pelo menos duas paredes, para permitir uma regeneração óssea previsível na área do defeito. Os biomateriais usados incluem o próprio implante, a membrana e o material para preenchimento ósseo (21).
Seguindo esta linha de raciocínio, algumas modificações da técnica foram descritas com o objetivo de criar e manter o espaço para que ocorra a regeneração, mas, ao mesmo tempo, simplificando o procedimento cirúrgico e reduzindo o risco de complicações (10,22).
Na técnica modificada, faz-se uso de um fi o de sutura de reabsorção lenta, o PDS II, como arcabouço para auxiliar na sustentação da membrana reabsorvível e, ao mesmo tempo, manter de maneira mais eficiente o espaço necessário para que ocorra a regeneração (10,22).
O PDS, ou polidioxanona, é um material de sutura sintético e reabsorvível. É constituído por polímero monofilamentado que apresenta elasticidade, com maior flexibilidade e tempo de tensão de estiramento aumentado. É biodegradável, o que acontece por lenta ação hidrolítica, em velocidade regular e de maneira previsível nos tecidos. Não apresenta efeitos colaterais como reação alérgica, aderência e proliferação de bactérias, além de não absorver fluidos bucais (10).
É capaz de manter 70% de sua resistência à tensão por duas semanas, caindo para 50% após as seis primeiras semanas. Sendo absorvido em 180 dias, desaparece totalmente ao final da reparação. Estas características garantem o bom resultado dos trabalhos, tendo em vista que, da mesma forma que as barreiras, o PDS deve permanecer em seu local tempo suficiente para permitir a colonização e a organização do tecido neoformado (10,22).
Assim, o objetivo deste trabalho foi apresentar e discutir o resultado clínico da utilização do PDS II como uma alternativa coadjuvante, de forma simples e econômica, para se obter e manter um arcabouço, favorecendo a regeneração óssea em áreas de defeitos peri-implantares, com baixo risco de complicações.
Relato de Caso Clínico
Paciente PFN, 40 anos, gênero masculino, não fumante, sistemicamente saudável, procurou atendimento para que fosse realizada a reabilitação protética com implantes dentários na região anterior da maxila.
Através de exame físico (Figuras 1 e 2) e por imagens (Figuras 3 a 5), detectou-se ausência dos dentes 12, 11, 21 e 22, além de reabsorção do rebordo alveolar anterior em espessura, constatando a necessidade de reconstrução cirúrgica para que os implantes pudessem ser instalados em posição adequada, do ponto de vista estético e funcional.
A escolha da técnica usada para a reconstrução foi baseada nas evidências clínicas e radiográficas citadas a seguir. A altura do rebordo era satisfatória, com possibilidade de travamento dos implantes em osso cortical da fossa nasal. A largura da crista, apesar de suficiente, apresentava um defeito vestibular significativo, com morfologia favorável que permitiria a obtenção de pelo menos duas paredes para uma regeneração óssea previsível. Assim, tentando simplificar e limitar o número de intervenções cirúrgicas foi proposta a técnica da ROG com o uso do PDS II e instalação simultânea de implantes.
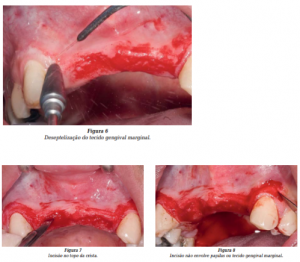
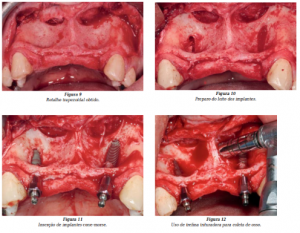
A técnica cirúrgica consistiu primeiramente na antissepsia intrabucal com clorexidina 0,2% e anestesia infiltrativa local. Em seguida, foi feita a deseptelização do tecido gengival marginal e papilas dos dentes adjacentes à área edêntula e parte palatina da crista óssea, usando uma broca maxicut (Figura 6). O objetivo deste cuidado foi evitar a exposição da estrutura óssea nestas regiões, prevenindo uma possível reabsorção óssea e, principalmente, aumentar a superfície conjuntiva de contato para o fechamento do retalho, evitando, assim, a invaginação do epitélio na linha de sutura e garantindo uma melhor cicatrização.
Um retalho trapezoidal espesso e com base ampla foi obtido de modo a garantir boa vascularização e proporcionar um fechamento primário do tecido mole, intacto e sem tensão. Foi feita uma incisão no topo da crista, que se estendeu no sentido vestibular dos dentes adjacentes, sem envolver papilas ou tecido gengival marginal já deseptelizados (Figuras 7 e 8). As incisões verticais relaxantes foram feitas de forma divergente na região distal dos caninos.
Em seguida, foi feito o deslocamento mucoperiosteal e a curetagem para remoção de todo tecido mole do córtex vestibular (Figura 9). O leito dos implantes foi preparado da maneira convencional, com uso de brocas de diâmetro progressivo e irrigação salina (Figura 10).
Os implantes foram inseridos no posicionamento tridimensional e eixo apropriado correto para permitir a colocação de coroas parafusadas. Foram usados implantes cone-morse, com medidas de 3,5 mm de diâmetro e 16 mm de altura, com travamento apical, em osso cortical da fossa nasal, em torno de 60 Ncm (Figura 11).
A posição do eixo dos implantes resultou, como esperado, em um defeito por fenestração vestibular bastante significativo que deveria ser preenchido. Para tal, foi coletado osso autógeno dentro do próprio retalho, na espinha nasal e na região apical de caninos, usando-se uma trefina trituradora (Figuras 12 a 14). O osso obtido foi misturado com biomateriais para preenchimento (hidroxiapatita e osso bovino liofilizado).
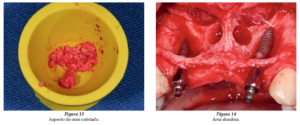
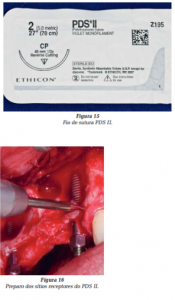
Antes do preenchimento do defeito, a estrutura óssea circundante, por ser cortical, necessitava de perfurações para abertura da cavidade medular e estimulação da cicatrização. A decorticalização é um procedimento de fundamental importância, pois permite que as células da medula povoem o sítio, aumentando e facilitando a angiogênese. Com este objetivo, foram usadas fresas de 0,8 mm de diâmetro, o mesmo do fio PDS (Figura 15), para que, ao mesmo tempo, pudessem ser preparados vários sítios receptores do PDS II com profundidade de 3 mm a 4 mm (Figura 16).
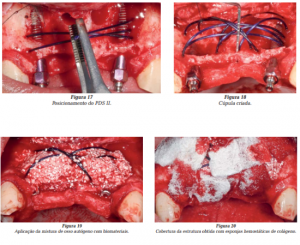
Nestes orifícios criados, foram posicionadas as extremidades de pedaços do PDS II, previamente cortados no comprimento desejado, de maneira a criar uma cúpula de altura em torno de 12 mm acima da superfície óssea, promovendo sobrecontorno e servindo de estrutura anatômica de suporte para uma estética agradável no tecido mole (Figuras 17 e 18).
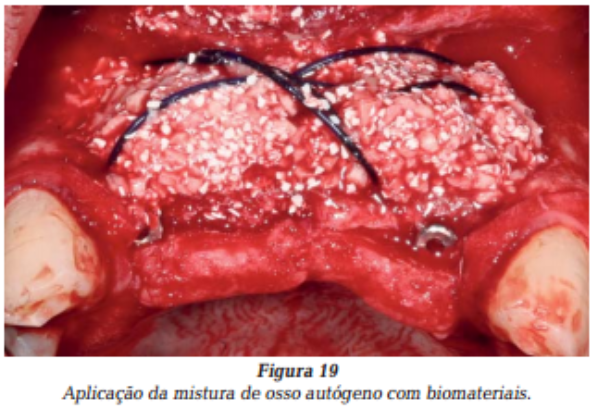
Uma vez obtido o espaço necessário, a mistura do osso autógeno com biomateriais foi aplicada para a cobertura das superfícies expostas dos implantes e preenchimento do espaço criado sob a cúpula (Figura 19).
Toda a estrutura foi coberta por esponjas hemostáticas de colágeno, de forma a proporcionar uma matriz para reforço adicional ao coágulo formado e ajudar a manter o material de preenchimento em posição (Figura 20).
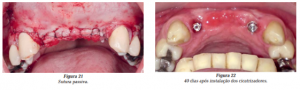
A cirurgia foi finalizada com o fechamento primário da ferida, após a incisão relaxante do periósteo. Foi realizada a sutura de forma passiva, mantendo a estabilidade do retalho (Figura 21).
A prótese removível usada foi cuidadosamente ajustada e aliviada sobre a região operada, sendo aconselhado não usá-la durante os três primeiros dias, quando o edema poderia ser maior.
Foram recomendados cuidados pós-operatórios e manutenção de uma correta higiene bucal complementada com o uso de digluconato de clorexidina (0,12%) duas vezes ao dia, durante 14 dias. No final deste período foi removida a sutura.
A fase de recuperação aconteceu sem nenhuma intercorrência. Completados os seis meses de consolidação da regeneração e da osseointegração dos implantes, realizou-se a reentrada cirúrgica para a colocação dos cicatrizadores. Nesta etapa cirúrgica foi possível confirmar o sucesso do procedimento. Os implantes estavam osseointegrados, sem sinais de inflamação peri-implantar ou perda óssea. Clinicamente, observou-se um aumento horizontal bem-sucedido.
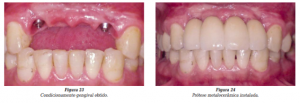
Depois de 40 dias de cicatrização (Figura 22), o paciente recebeu uma prótese provisória fixa sobre os implantes. Após condicionamento gengival realizado (Figura 23), objetivando formar papilas, já se pôde notar resultado estético e funcional favorável.
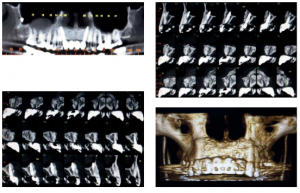
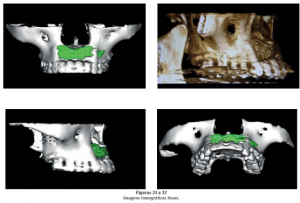
A prótese metalocerâmica definitiva foi instalada (Figura 24) e a tomografia final realizada (Figuras 25 a 32), demonstrando o sucesso da técnica proposta.
Discussão
Os enxertos autógenos em bloco são os únicos que oferecem estabilidade mecânica contra a pressão do tecido mole sobrejacente, desde que imobilizados com parafusos de fixação. Quando particulados, o potencial osteogênico é aumentado, mas desaparece a possibilidade de fixação do enxerto, com comprometimento da estabilidade mecânica necessária (18).
Evidências científicas de estudos clínicos e experimentais documentaram a adequacidade do autoenxerto particulado para o aumento ósseo, onde um enxerto altamente osteogênico é necessário. A técnica da ROG, com uso de membranas, tem sido uma alternativa para contornar as dificuldades nos processos de reparo do tecido ósseo em defeitos críticos, onde se quer fazer uso de osso particulado (4-6).
No entanto, os problemas mais frequentes associados a esta técnica são o colapso total ou parcial da membrana sobre o defeito ósseo, a exposição da membrana por deiscência do tecido mole e o alto grau de habilidade técnica necessária por parte do profissional (7).
As membranas reabsorvíveis geralmente não são capazes de manter o espaço, por perderem aos poucos a resistência mecânica. Frequentemente, são utilizadas em associação com biomateriais e enxertos ósseos para impedir o colapso. Atualmente, mesmo as membranas reforçadas e não reabsorvíveis são suportadas por materiais para enxerto, a fi m de alcançar resultados melhores nos procedimentos de ROG. No entanto, uma segunda cirurgia para removê-las envolve desconforto e custos para o paciente, assim como o risco de perda de parte do osso regenerado, já que o levantamento do retalho pode resultar em reabsorção óssea na crista (12).
A facilidade de manuseio também deveria ser uma característica importante, permitindo fácil recorte e adaptação ao tecido ósseo pelo profissional (13).
Apesar de ainda serem os autoenxertos considerados o padrão ouro na cirurgia óssea reconstrutiva, foram relatadas algumas desvantagens, como reabsorção imprevisível, morbidade do sítio doador e possibilidade da quantidade necessária não estar disponível (18).
Em função destas dificuldades, a busca por alternativas adequadas, incluindo materiais e técnicas cirúrgicas, tem sido uma constante. Mas, cada material tem suas peculiaridades e a técnica se torna complexa e, às vezes, de difícil reprodução nas mãos da maioria dos clínicos, que deveriam conhecer as características das diferentes alternativas e dominar todos os passos do procedimento (22).
O uso do fi o de sutura PDS II, na técnica proposta neste caso, pode simplificar a técnica já empregada na ROG, oferecendo mais uma alternativa de tratamento a ser oferecida aos pacientes (22).
Ao observarmos os fatores que contribuem para o sucesso das técnicas em que as membranas são utilizadas, notamos que em nada diferem quando consideramos o uso do PDS (10,22).
O PDS, ou polidioxanona, empregado da maneira descrita neste trabalho, atua de forma a aumentar a eficiência do arcabouço, necessário para sustentação do tecido gengival, criando e mantendo espaço suficiente para proteção do coágulo formado, permitindo proliferação celular. Por ter como propriedades a reabsorção lenta e a resistência à tensão, o PDS se mantém convexo, no local desejado, durante o tempo necessário para que ocorram colonização, organização e proteção do tecido neoformado (10,22).
Os resultados são semelhantes aos obtidos com o emprego das membranas não reabsorvíveis com reforço. No entanto, por ser reabsorvível, apresenta a vantagem de eliminar a necessidade de uma segunda intervenção cirúrgica para sua remoção, além de não promover qualquer reação tecidual e desaparecer completamente ao final da reparação (22).
Contudo, apesar do sucesso obtido, ainda não se pode atribuir unicamente ao PDS II o sucesso da técnica proposta. Mais estudos, clínicos e histológicos, são necessários para esclarecer se o resultado obtido seria o mesmo, caso não se empregasse, ao mesmo tempo, membrana e biomateriais. Só assim, a função de arcabouço poderia ser confirmada e, de maneira concreta, contribuir para avanço e evolução das técnicas de regeneração.
Conclusão
O emprego do PDS II pode representar uma alternativa de tratamento com previsibilidade de sucesso no reparo do tecido ósseo em defeitos críticos, onde se quer fazer uso de osso particulado.
Por ser uma técnica simples, de baixo custo e de fácil reprodução, pode ser aplicada na clínica diária, desde que observada a correta indicação.
No entanto, apesar do resultado clínico apresentado, mais estudos clínicos e histológicos precisam ser avaliados com o objetivo de investigar a estabilidade longitudinal da regeneração com o uso da técnica proposta.
Nota de esclarecimento
Nós, os autores deste trabalho, não recebemos apoio financeiro para pesquisa dado por organizações que possam ter ganho ou perda com a publicação deste trabalho. Nós, ou os membros de nossas famílias, não recebemos honorários de consultoria ou fomos pagos como avaliadores por organizações que possam ter ganho ou perda com a publicação deste trabalho, não possuímos ações ou investimentos em organizações que também possam ter ganho ou perda com a publicação deste trabalho. Não recebemos honorários de apresentações vindos de organizações que com fi ns lucrativos possam ter ganho ou perda com a publicação deste trabalho, não estamos empregados pela entidade comercial que patrocinou o estudo e também não possuímos patentes ou royalties, nem trabalhamos como testemunha especializada, ou realizamos atividades para uma entidade com interesse financeiro nesta área.
Referências
- Cury AA. Planejamento das reconstruções de defeitos ósseos maxilomandibulares. In: Querido MRM. Implantes Osseointegrados – Inovando Soluções. São Paulo; Ed. Artes Médicas 2004.p.79-90.cap.5.
- Nyman S, Lindhe J, Karring T, Rylander H. New attachment following surgical treatment of human periodontal disease. J Clin Periodontol 1982;9:290-6.
- Gottlow J, Karring T, Nyman S. Guided tissue regeneration following treatment of recession-type defects in the monkey. J Periodontol 1990;61:680-5.
- Dahlin C, Sandberg E, Alberius P, Linde A. Restoration of long-standing mandibular nonunion bone defects. An experimental study in rats using an osteopromotive membrane method. Int J Oral Maxillofac Surg 1994;23(4):237-42.
- Bosch C, Melsen B, Vargervik K. Guided bone regeneration in calvarial bone defects using polytetrafl uoroethylene membranes. Cleft Palate Craniofac J Denmark 1995;32:311-7.
- Lundgren A, Lundgren D, Taylor A. Infl uence of barrier occlusiveness on guided bone augmentation. An experimental study in the rat. Clin Oral Implants Res 1998;9:251-60.
- Andrade-Acevedo R, Trentin MS, Shibli JA, Marcantonio Jr. E. Bases clínicas e biológicas da regeneração óssea guiada (ROG) associada a barreiras ou membranas. Rev Bras Implantodontia & Prótese sobre Implantes 2004;11(43):251-7.
- Selvig K, Nilveus R, Fitzmorris L, Kersten B, Khorsandi S. Scaning electronic microscopic observations of of cell populations and bacterial contamination of membranes used for guided periodontal tissue regeneration in humans. J Periodontol 1990;61:515-20.
- Hardwick R, Hayes BK, Flynn C. Devices for dentoalveolar regeneration: an up-to-date literature review. J Periodontol 1995;66(6):495-505.
- Tinti C, Manfrini F, Parma-Benfenati S. A bioresorbable barrier in the treatment of gingival recession: Description of a new resorbable dome device. Int J Periodont Rest Dent 2001;21:1-9.
- Buser D. 20 Anos de Regeneração Óssea Guiada na Implantodontia.São Paulo: Quintessence; 2010.p.123-52.
- Bornstein MM, Arx T, Bosshardt DD. Propriedades das membranas usadas como barreiras. In: Buser D, 20 Anos de Regeneração Óssea Guiada na Implantodontia.São Paulo: Quintessence; 2010.p.47-69.
- Tatakis DN, Promsudthi A, Wikesjö UMO. Devices for periodontal regeneration. Periodontol 2000 1999;19:59-73.
- Vert M, Li S, Garreau H. New insights on the degradation of bioresorbable polymeric devices based on lactic and glycolic acids. Clin Mater 1992;10(1-2):3-8.
- Wolf HF, Rateitschak EM, Rateitschak KH. Periodontia. 3ª ed revista e ampliada. São Paulo: Artmed; 2006.p.435-8.
- Mellonig J. Autogenous and allogeneic bone grafts in periodontal therapy. Crit Rev Oral Biol 1992;3:333-52.
- Tinti C, Vincenzi G. Expanded polytetrafl uoroethylene titanium-reinforced membranes for regeneration of mucogingival recession defects. A 12-case report. J Periodontol 1994;65:1088-94.
- Jensen SS, Bosshardt DD, Buser D. Enxertos ósseos e materiais substitutos ósseos. In: Buser D, 20 Anos de Regeneração Óssea Guiada na Implantodontia. São Paulo: Quintessence; 2010.p.71-96.
- Buser D, Hoffman B, Bernard JP, Lussi A, Mettler D, Schenk RK. Evaluation of fi lling materials in membrane-protected bone defects. A comparative histomorphometric study in the mandible of miniature pigs. Clin Oral Implants Res 1998;9:137-50.
- Garg AK. Autogenous mandibular bone grafts in the treatment of the resorbeb maxillary anterior alveolar ridge: Rationale and approach. Implant Dent 1998;7:169-76.
- Arx T, Buser D. Regeneração óssea guiada e enxertos autógenos em bloco para o aumento horizontal do rebordo: uma abordagem segmentada. In: Buser D. 20 Anos de Regeneração Óssea Guiada na Implantodontia.São Paulo: Quintessence; 2010.p.195-229.
- Alves DCC, Souza ET, Carvalho PSP. Recobrimento radicular utilizando a técnica do PDS II. PerioNews 2010;4(5):441-7.