Publicado em: REVISTA CATARINENSE DE IMPLANTODONTIA – ANO 16 – Nº 17.
Autor(a)(es): Mariá Pacheco Abraham – CRO-SC 13115 – Cirurgiã-Dentista – Especializanda em Implantodontia.
RESUMO
Um dos grandes desafios da investigação clínica atual tem sido o desenvolvimento de aditivos cirúrgicos que ajudem a regularizar a inflamação e aumentar a velocidade do processo de cura. Há mais de 30 anos iniciou-se o estudo de aplicação de fatores de crescimento no local cirúrgico, com os concentrados plaquetários, destacando a PRF por ser muito próxima a um coágulo sanguíneo natural, ter um protocolo de obten-
ção simples e de baixo custo, e estudos mostrando sua eficácia clínica com muitas indicações, principalmente em cirurgia oral. Esta revisão de literatura traz um breve histórico sobre o surgimento e evolução destes concentrados; focando em sua segunda geração, denominada Fibrina autóloga rica em plaquetas e leucócitos, seu protocolo de obtenção, vantagens, limitações e aplicações clínicas.
Palavras-chave:
Fibrina, Cicatrização, Fatores de crescimento
INTRODUÇÃO
O principal objetivo de qualquer tratamento cirúrgico é a manutenção de uma ótima saúde, conforto, funcionalidade e
estética do paciente. (MESHRAM et al., 2015) Apesar dos avanços modernos em técnicas e dispositivos de fechamento
de feridas, há uma necessidade vital de novos métodos para melhorar o processo de cura para alcançar resultados ideais.
(DESAI et al.,2013)
Um dos grandes desafios de investigação clínica tem sido o desenvolvimento de aditivos cirúrgicos bioativos, que ajudam a regular a inflamação e aumentar a velocidade do processo de cura. A cicatrização dos tecidos duros e moles é mediada por amplos eventos intra e extra articulares. A compreensão de todos estes processos ainda não esta completa, no entanto, sabe-se que as plaquetas desempenham um papel crucial não apenas na hemóstase, mas também no processo de cicatrização de feridas. (SALUJA, DEHANE e MAHINDRA, 2011)
A reparação é definida como a cicatrização da ferida por um tecido que não tenha completamente restaurada a arquitetura ou função da peça. (MESHRAM et al., 2015)
A regeneração é definida como a reprodução ou reconstituição de uma parte perdida ou lesada do corpo de tal maneira que a arquitetura e função dos tecidos perdidos ou feridos estão completamente restauradas. (SHIVASHANKAR et al.,2013)
REVISÃO DE LITERATURA
Raja e Naidu (2008) descreveram a evolução de um novo concentrado de plaquetas, referido como PRF. Desenvolvido por Choukroun, este concentrado de plaquetas de segunda geração eliminou oS riscos associados a utilização de trombrina bovina utilizada na técnica de PRP. As vantagens da PRF em comparação a PRP são sua técnica mais simplificada e a falta de manuseamento bioquímico do sangue. A quantidade necessária de sangue é retirada em tubos de ensaio de 10 ml sem anticoagulante e imediatamente centrifugado durante 12 minutos a 2.700 rpm. Pela ausencia de anticoagulante, o sangue começa a coagular logo que entra em contato com a superfície do tubo. Portanto, para preparação com êxito da PRF, a colheita de sangue e imediata centrifugação, antes da cascata de coagulação ser iniciada é absolutamente essencial. Pode ser obtida em forma de gel e ser usado com conjunto com enxertos ósseos, oferencendo várias vantagens incluindo a promoção da cicatrização de feridas, crescimento e maturação óssea, estabilização do enxerto, vedação da ferida e hemostasia. Também pode ser usado como uma membrana. Os
autores concluem, dizendo que a popularidade do material deve aumentar, considerando suas muitas vantagens. No futuro, mais avaliações histológicas são necessárias para entender os benefícios deste concentrado de plaquetas de segunda geração.
Antezana e Gatica (2011) utilizaram a técnica de PRF de Chouckoun para o preparo do enxerto ósseo, que consiste em obter uma amostra de sangue venoso, colocados em tubos de ensaio de 10ml hermeticamente fechados. Estes tubos foram distri- buidos na centrifuga e sujeitos a uma centrifugação que varia entre 2700-3000 rpm durante 10-12 minutos, respectivamente. A ausencia de anticoagulantes implica na ativação das plaquetas em poucos minutos, para haver sucesso desta técnica depende da velocidade coleta de sangue e centrifugação. Se houver falha, a fibrina irá se polimerizar no tubo de forma difusa e se obterá um pequeno coagulo sem consistência. Uma vez preparado o material de preenchimento, ele é colocado na cavidade criada e depois é recoberto pela membrana. Por fim, é realizada a sutura. Os autores concluiram que o efeito da PRF é pouco conhecida e requer mais estudos para seu verdadeiro entendimento, desta maneira haverá uma maior compreensão dos resultados obtidos e
posteriormente uma correta aplicação. Marrelli e Tatullo (2013) tiveram como objetivo avaliar um protocolo previsível, a fim de aumentar os tecidos de manutenção peri-implantares de alvéolos onde serão instalados implantes imediatos, graças ao uso de membranas de fibrina rica em plaquetas (PRF). Foi realizado um estudo obervacional de 127 implantes dentais cônicos, colocados imediatamente após extração em maxilas de 59 pacientes. Extração dentária atraumática e implantes sem retalho foram realizados em todos os casos. A posição do osso cortical em relação ao implante foi mensurada duranre a cirurgia. O “gap”entre o tecido ósseo e a superfície do implante foi medido até no máximo 3mm. Após a colocação dos implantes, encheram o local cirúrgico com gel de PRF, de modo a preencher a diferença entre osso e superfície do implante, então cobriram o local cirúrgico com uma membrana de PRF, de modo a revestir o fosso entre a crista alveolar e o implante. Em todos os casos, foi observado o completo recobrimento dos implantes dentários com um novo tecido macio de espessura variável entre 1 e 3mm. A adaptação do osso cortical, a partir da colocação do implante até os 30 meses seguintes da restauração protética, variou entre 0.4 a 1.7mm. O estudo mostrou uma série de reabilitações de sucesso, com técnica de implantodontia pós-extração em 98% dos casos, apesar das taxas de sucesso a médio e longo prazo com a mesma técnica variem na literatura entre 92,7% e 98%. Manutenção em longo prazo da crista óssea e rápida cicatrização da dimensão do tecido mole
com manutenção de papila foram observados como resultado após a colocação imediata de implante dentário após extração.
Meza et al. (2014) descreveram, através de revisão de literatura, as propriedades biológicas e aplicações clínicas da PRF na cirurgia muco gengival (cobertura radicular) e no levantamento do piso do seio maxilar. Estudos tem demonstrado que após a centrifugação, 97% das plaquetas e 50% dos leucócitos do volume de sangue original, se concentram na PRF.
Autores concluiram que a fibrina rica em plaquetas é um concentrado plaquetário de fácil manipulação e viável para uso na prática clínica. No tratamento de recessões gengivais, a PRF evita a necessidade de obter enxertos de área doadora, o que diminui a morbidade pós operatória, porém, observou-se que a porcentagem de cobertura radicular é inferior, comparada ao enxerto de tecido conjuntivo subepitelial.
A PRF como biomaterial de preenchimento no levantamento de seio maxilar é uma opção relevante, já que estudos demonstram topograficamente e histologicamente, que há regeneração óssea.
DISCUSSÃO
Plaquetas: As plaquetas são fragmentos citoplasmáticos anucleados derivados a partir de megacariócitos de medula óssea, medindo de 2 a 4 mm de diâmetro, sendo o segundo corpúsculo mais numeroso no sangue. Seu tempo de vida varia entre 7 e 12 dias.
Os elementos mais importantes das plaquetas para realização dos processos de cura e reparação são os leucócitos e fatores de crescimento natu- rais, sendo este último, polipeptídeos de sinalização que atraem macrófagos, e participam na diferenciação, proliferação, migração e no metabolismo celular.
Fatores de crescimento: O raciocínio científico por trás do uso dos concentrados de plaquetas reside no fato de possuírem fatores de crescimento, conhecidos por desempenhar um papel fundamental em mecanismos de reparação em tecidos duros e moles. Exibem propriedades quimiotáxicas e mitogênicas que promovem e modulam funções celulares envolvidas na hemostase, cicatrização de tecidos, regeneração e proliferação celular.
Plasma rico em Plaquetas: PRP:
Na década de 90, com o rápido desenvolvimento das técnicas e equipamentos, o plasma rico em pla- quetas, que continha uma maior concentração de plaquetas do que a cola de fibrina utlizada nos anos 70, estava disponível. O primeiro estudo com PRP realizado no campo da cirurgia oral foi introduzido por Whitman et al. em 1997.
Aplicações clínicas:
– Procedimentos de elevação de seio maxilar.
– Preservação de alvéolo.
– Defeitos infra-ósseos.
– Cirurgias de reconstrução de mandíbula.
– Procedimentos de tecido mole como enxertos gengivais e subepiteliais, devido a sua propriedade de reparo.
Limitações:
– Uso de trombina bovina em certas preparações comerciais, podendo haver coagulopatias e episódios de sangramento raro, tendo efeitos tóxicos sobre as células do corpo.
– Falta de uniformidade no protocolo de preparação da PRP com diferentes concentrações de plaquetas e tempo de armazenamento.
-Estudos mostraram que a PRP tem limitado potencial para estimular a regeneração do osso, uma vez que libera os fatores de crescimento rápido, pouco antes do crescimento celular a partir do tecido circundante.
Fibrina: Molécula de ligação que permite uma série de interações celulares e fornece uma matriz provisó- ria na qual as células podem proliferar, organizar e realizar suas funções, principalmente em locais que sofreram lesão ou inflamação.7 Presente no plasma e nas plaquetas, desempenha um papel determinante na agregação plaquetária durante a hemostase. É transformada em um tipo de cola biológica capaz de consolidar o agrupamento inicial de plaquetas, constituindo, assim, uma barreira de proteção ao longo de violações vasculares durante a coagulação
Fibrina rica em plaquetas: PRF Técnica desenvolvida e descrita pela primeira vez na França por Choukroun et al. em 2001, referi- do como um concentrado de plaquetas de segunda geração, produzido sem quaisquer agente antico- agulante e para uso específico em cirurgia oral e maxilo-facial. Material de regeneração que contém elevados fatores de crescimento. Acumula todos os componentes da amostra de sangue favoráveis a cura e imunidade em apenas uma matriz de fibrina. PRF é constituído por uma matriz autóloga de fibrina, composto por uma estrutura tetramolecular, que atua como um andaime biodegradável a incorpo- ração de plaquetas, leucócitos, citocinas e células tronco circulantes, favorecendo o desenvolvimento de microvascularização e capaz de guiar a migração de células em sua superfície. Além disso, pode servir como um veículo para assegurar células envolvidas na regeneração do tecido e parece ter uma liberação controlada de fatores de crescimento em um período entre 1 e 4 semanas, estimulando o ambiente de cicatrização de feridas.
Protocolo: Processo de produção completamente natural sem uso de anticoagulante durante a colheita do sangue, nem trombina bovina e cloreto de cálcio para ativação plaquetária e polimerização da fibrina. Uma amostra de sangue intravenoso é tomada em tubos de ensaio de vidro à vácuo sem anticoa- gulante, ou seja, secos, e imediatamente centrifu- gadas a uma velocidade que varia de 2700/3000 RPM durante 12/10 minutos, respectivamente.

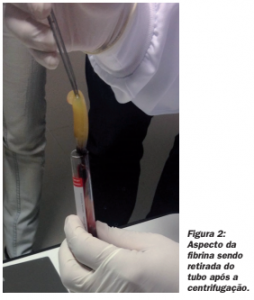
Matriz de fibrina: Fibrina é a guia natural da angiogênese, retém as células-tronco circulantes e fornece uma cober- tura epitelial protegendo a ferida.30 A conversão de fibrinogênio em fibrina ocorre lentamente com pequenas quantidades de trombina fisiologicamente disponíveis presentes na amostra de sangue em si. Assim, uma arquitetura fisiológica, favorável ao processo de cura é obtida devido à lenta polimerização. A rede de fibrina gerada com o protocolo de PRF é muito semelhante a uma natural, e conduz a uma migração e proliferação celular (células endoteliais e fibroblastos) mais eficiente, ocorrendo assim a cicatrização.
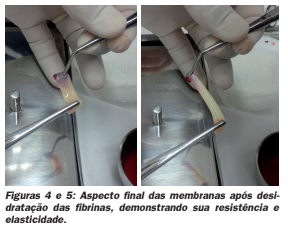
Membrana de fibrina: Para a formação da membrana, coloca-se o co- águlo de PRF entre duas camadas de gaze estéril e há compressão durante 10 minutos para permitir que os fluidos presos na matriz sejam removidos, obtendo assim uma forte e resistente membrana. Hoje já existem kits específicos para sua conformação. A Membrana de PRF se degrada em 1-2 semanas.

Associação com outros biomateriais:
– Auto regulação dos fenômenos inflamatórios e infecciosos no interior do material enxertado.
– Facilita a migração celular, vascularização e so- brevivência do enxerto
– Atua como adesivo biológico para manter as partí- culas de enxerto em conjunto, facilitando sua manipulação.
– Acelera a integração e remodelação do biomate- rial enxertado.
– Melhora a densidade do enxerto ósseo.
Fibrina Ria em plaquetas injetável (i-PRF):
Protocolo:
Para obtenção do i-PRF, é realizada coleta de sangue em tubos de plástico à vácuo e sem anti- coagulantes que são imediatamente centrifugados a uma velocidade de 3300 RPM durante 2 minutos. Com o término deste processo, é possível observar no tubo uma área de cor alaranjada (i-PRF) e o res- tante do material sanguíneo logo abaixo. Em segui- da, os tubos são abertos de forma cuidadosa para não haver homogeneização do material, e utilizando uma pipeta ou seringa com agulha hipodérmica, foi coletado o i-PRF dos tubos. Pode ser utilizado na for- ma líquida ou polimerizado. Após 5 minutos foram acrescentadas aos poucos, as partículas de enxerto ósseo. Em 15 minutos é possível observar o início da polimerização, estando o material pronto para o uso no tempo total de 20 minutos, podendo ser re- movido para a realização do enxerto.


CONCLUSÃO
Com uma ampla possiblidade de aplicações e excelentes resultados, apoiado nos estudos já publicados, os agregados plaquetários surgiram como uma alternativa vantajosa de biomateriais, principalmente na área de cirurgia oral. Dentre os tipos de concentrados, o PRF se destaca por ser o mais parecido com o coágulo natural, não necessitando de nenhum tipo de susbtância bioquímica, apenas do sangue puro autólogo, eliminando assim o risco de infeção cruzada ou reações alérgicas. Suas características de hemostasia e suporte do sistema imune contribuem para a diminuição da morbi- dade em procedimentos. Também mostrou ser eficiente nos efeitos secundários da inflamação como dor e edema, gerando uma boa aceitação por parte dos pacientes. Possui um protocolo simples e de baixo custo onde é possível obter altas concentrações de fatores de crescimento, tornando a cicatrização de feridas e a regeneração de tecidos mais eficazes e qualificadas, gerando resultados clínicos mais previsíveis e satisfatórios para quem o utiliza. É uma terapia promissora, contudo, por ser um tema atual, necessita mais estudos clínicos de acompanhamento.
Por ser uma bibliografia de conclusão de curso, você poderá encontrá-la, na íntegra, nos anais da ABO SC

